|
ГИПОТАЛАМУС [ hypothalamus ] (Греч.: ίπό - приставка, в сложных словах: под; ниже; + θάλαμος - спальня, брачное ложе, 1896).
Гипоталамус - это область головного мозга, совокупность анатомических структур, которая составляет центральные отделы промежуточного мозга и участвует в образовании дна III желудочка. К гипоталамусу относятся зрительный перекрест (перекрест зрительных нервов), зрительный тракт, серый бугор с воронкой, а также сосцевидные тела. Главные образования гипоталамуса показаны на схеме ниже.
В дистальном (заднем) направлении от межжелудочкового отверстия тянется, огибая таламус снизу, гипоталамическая борозда, sulcus hypothalamicus. Образования центральной части промежуточного мозга, расположенные книзу от этой борозды, относятся к гипоталамусу, hypothalamus. Структуры гипоталамуса: зрительный перекрест, серый бугор, воронка, гипофиз и сосцевидные тела, участвующие в образовании дна III желудочка.
Зрительный перекрест, chiasma opticum (схема, п. 24), имеет вид поперечно лежащего валика. Валик образован частично переходящими на противоположную сторону волокнами зрительных нервов (II пара черепных нервов). Перекрест с каждой стороны латерально и кзади продолжается в зрительный тракт, tractus opticus.
Зрительный тракт - образование, располагающееся медиально и сзади от переднего продырявленного вещества (схема, п. 5),. Зрительный тракт огибает ножку мозга с латеральной стороны и заканчивается двумя корешками в подкорковых центрах зрения. Более крупный латеральный корешок, radix lateralis, подходит к латеральному коленчатому телу, а более тонкий медиальный корешок, radix medialis, направляется к верхнему холмику крыши среднего мозга.
К передней поверхности зрительного перекреста прилежит и срастается с ним терминальная пластинка, относящаяся к конечному мозгу. Конечная пластинка замыкает передний отдел продольной щели полушарий головного мозга и состоит из тонкого слоя серого вещества, которое в латеральных отделах пластинки продолжается в вещество лобных долей полушарий головного мозга.
Кзади от зрительного перекреста находится серый бугор, tuber cinereum (схема, п. 22), позади которого лежат сосцевидные тела, а по бокам - зрительные тракты. Книзу серый бугор переходит в воронку, infundibulum, которая соединяется с гипофизом (см. Ядра гипоталамуса, схема, п. 10). Стенки серого бугра образованы тонкой пластинкой серого вещества, содержащего ядра серого бугра (серобугорные ядра), nuclei tuberales. Co стороны полости III желудочка в область серого бугра и далее в воронку вдается суживающееся углубление воронки (см. Ядра гипоталамуса, схема, п. 8),.
Сосцевидные тела, corpora mamillaria (схема, п. 21), расположены между серым бугром спереди и задним продырявленным веществом сзади. Они имеют вид двух небольших, диаметром около 0,5 см каждый, сферических образований белого цвета. Белое вещество расположено только снаружи сосцевидного тела. Внутри находится серое вещество, в котором выделяют медиальные и латеральные ядра сосцевидного тела, nuclei corporis mamillaris medialis et laterales. В сосцевидных телах заканчиваются столбы свода конечного мозга.
В гипоталамусе различают три основные области скопления различных по форме и размерам групп нервных клеток: переднюю гипоталамическую область, regio hypothalamica anterior; промежуточную гипоталамическую область, regio hypothalamica intermedia, и заднюю гипоталамическую область, regio hypothalamica posterior. Скопления нервных клеток в этих областях образуют более 30 ядер гипоталамуса.
Определенные нейроны (нейросекреторные клетки) ядер гипоталамуса обладают способностью вырабатывать нейросекреты, которые по отросткам этих же клеток могут транспортироваться в гипофиз. Ядра, содержащие такие клетки, получили название нейросекреторных ядер гипоталамуса. В передней области гипоталамуса находятся супраоптическое (надзрительное) ядро, nucleus supraopticus, и паравентрикулярные ядра, nuclei paraventriculares. Отростки клеток этих ядер образуют гипоталамо-гипофизарный пучок, заканчивающийся в задней доле гипофиза. Среди группы ядер задней области гипоталамуса наиболее крупными являются медиальное и латеральное ядра сосцевидного тела, nuclei corporis mamillaris medialis et lateralis, и заднее гипоталамическое ядро, nucleus hypothalamicus posterior. К группе ядер промежуточной гипоталамической области относятся: нижнемедиальное и верхнемедиальное гипоталамическое ядра, nuclei hypothaldmici ventro-medialis et dorsomedialis; дорсальное гипоталамическое ядро, nucleus hypothalamicus dorsalis; ядро воронки, nucleus infundibularis; серобугорные ядра, nuclei tuberales, и др.
Ядра гипоталамуса взаимосвязаны друг с другом и с другими структурами нервной системы сложной системой афферентных и эфферентных волокон (проводящих путей). Доказано, что гипоталамус координирует практически все системы органов и управляет сенсорными, двигательными и вегетативными функциями организма. Нейросекреты ядер гипоталамуса влияют на функции различных железистых клеток гипофиза, усиливая или ослабляя секрецию гормонов гипофиза. Так гормоны гипофиза являются исполнительным механизмом в управлении функциями практически всех других желез внутренней секреции. Наличие нервных и гуморальных связей гипоталамических ядер с гипофизом является основанием для рассмотрения гипоталамуса и гипофиза как гипоталамо-гипофизарной системы.
Гемациркуляция гипоталамуса. Гемациркуляторное русло гипоталамуса начинается приносящими гипофизарными артериями. Они вступают в медианное возвышение медиобазального гипоталамуса и ветвятся до артериол. Затем артериолы разветвляются в сеть гемакапилляров. Эта сеть называется первичным сплетением гемакапилляров гипоталамуса, или артериально-артериальным микрогемациркуляторным руслом гипоталамуса. Капилляры первичной сети образуют петли и клубочки, с которыми контактируют терминали аксонов нейросекреторных клеток аденогипофизотропной зоны гипоталамуса. Капилляры первичной сети вновь впадают в артериолы, которые сливаются в выносящие гипофизарные артерии.
|
Схема. Межножковая ямка нижней поверхности головного мозга и составляющие её структуры.
Модификация: Gray H., (1821–1865), Standring S., Ed. Gray's Anatomy: The Anatomical Basis of Clinical Practice. 39th ed., Churchill Livingstone, 2008, 1600 p., см.: Анатомия человека: Литература. Иллюстрации.
|
 |
|
|
Схема. Область гипоталамуса левого полушария головного мозга. Главные гипоталамические ядра. Разрез в сагиттальной медиальной плоскости. Вид справа.
Модификация: Gray H., (1821–1865), Standring S., Ed. Gray's Anatomy: The Anatomical Basis of Clinical Practice. 39th ed., Churchill Livingstone, 2008, 1600 p., см.: Анатомия человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Верхняя часть схемы - фрагмент гипоталамуса. Группа медиально расположенных ядер удалена. Нижняя часть схемы - увеличенный фрагмент головного мозга в центре которого расположен гипоталамус. Показаны группа латерально расположенных ядер имедиально расположенных ядер гипоталамуса. Латерально по отношению к своду (fornix) и сосцевидноталамическому тракту (mammillothalamic tract) находится латеральная гипоталамическая область (lateral hypothalamic region, закрашена пурпурным цветом). В задней части этой области (дорсально) расположено бугорнососцевидное ядро (верхняя часть схемы, tuberomammillary nucleus, закрашено красным цветом). Ростральнее в латеральной предоптической области гипоталамуса расположено латеральное предоптическое ядро (lateral preoptic nucleus). Перифорникальное ядро, или красная полоска (perifornical nucleus, red band)) охватывает свод (fornix). В латеральной гипоталамической области перифорникальное ядро объединяется с задним ядром гипоталамуса (posterior hypothalamic nucleus). Группа медиальных ядрер (medially placed nuclei, закрашены жёлтым цветом) расположены в пространстве между сосцевидноталамическим трактом и конечной пластинкой (lamina terminalis) мозолистого тела и распространяются каудальнее сосцевидноталамического тракта. Латеральные бугорные ядра (закрашены синим цветом) расположены вентрально по преимуществу в латеральной гипоталамической области. Супраоптическое ядро (supraoptic nucleus, закрашено зелёным цветом) может состоять из трёх довольно отчетливо выделяющихся частей: заднелатеральная часть , заднемедиальная часть ивентромедиальная часть . Промежуточное ядро гипоталамуса образовано тремя группами нейронов, расположенных между супраоптическим ядром и паравентрикулярным ядром. |
|
|
Схема. Главные группы нервных клеток и трактов в пределах гипоталамуса и около него. Горизонтальное сечение мозга.
Модификация: Gray H., (1821–1865), Standring S., Ed. Gray's Anatomy: The Anatomical Basis of Clinical Practice. 39th ed., Churchill Livingstone, 2008, 1600 p., см.: Анатомия человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
AH, anterior hypothalamic area - передняя область гипоталамуса;
Arc, arcuate nucleus - дугообразное ядро гипоталамуса;
AV, anteroventral preoptic nucleus - передневентральное предоптическое ядро;
BST, bed nucleus of stria terminalis - ядро ложа концевой полоски;
CP, caudate nucleus and putamen - хвостатое ядро и скорлупа;
DBB, nucleus of diagonal band - ядро диагональной полоски;
DM, dorsomedial nucleus - дорсомедиальное ядро;
LHA, lateral hypothalamic area - латеральная область гипоталамуса;
MB, mammillary body (mainly medial mammillary nucleus) - сосцевидные тела (главным образом медиальные сосцевидное ядро);
MeP, median preoptic nucleus - срединное предоптическое ядро;
MP, medial preoptic nucleus - медиальное предоптическое ядро;
NAc, nucleus accumbens - прилежащее ядро;
OVLT, vascular organ of the lamina terminalis - гемасосудистый орган конечной пластинки конечного мозга;
PAG, periaqueductal grey matter - околоводопроводное серое вещество;
PHA, posterior hypothalamic area - задняя область гипоталамуса;
PV, periventricular nucleus - перивентрикулярное ядро;(PVpo, preoptic part - предоптическая часть; PVa, anterior part - передняя часть; PVp, posterior part - задняя часть)
PVH, paraventricular (hypothalamic) nucleus - паравентрикулярное ядро (гипоталамуса);
Se, septal cortex - кора перегородки;
SCh, suprachiasmatic nucleus - супрахиазматическое ядро;
T, midbrain tegmentum - покрышка среднего мозга;
TM, tuberomammillary nucleus - бугорнососцевидное ядро;
VM, ventromedial nucleus - вентромедиальное ядро;
VTA, ventral tegmental area - вентральная область покрышки среднего мозга.
Fibre tracts (shaded) - тракты нервных волокон (закрашены более темным цветом):
CP, cerebral peduncle - ножки полушарий головного мозга;
F, fornix - свод мозга;
MFB, medial forebrain bundle - медиальный пучок переднего мозга;
MTT, mammillothalamic tract - сосцевидноталамический тракт;
OT, optic tract - зрительный тракт. |
|
|
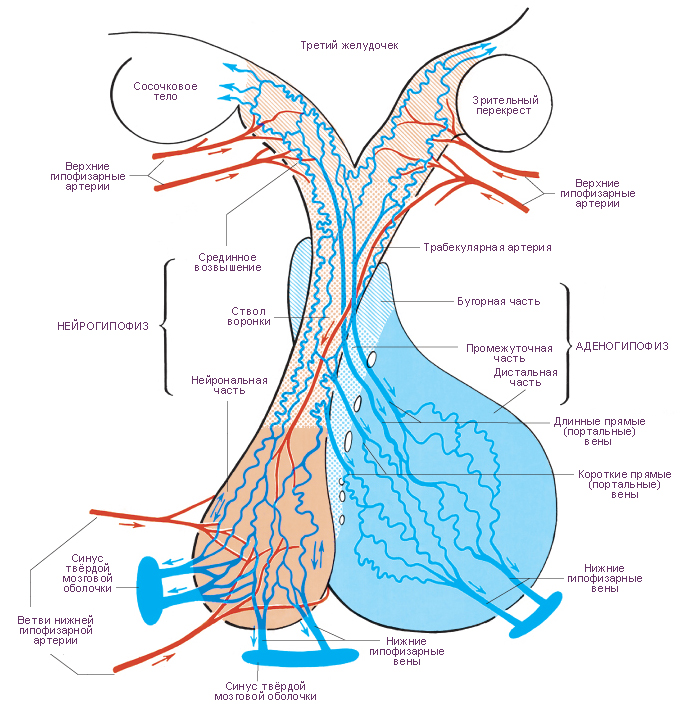
Схема. Кровеносные сосуды гипоталамуса: срединного возвышения, воронки серого бугра; гипофиза и смежных структур.
Модификация: Gray H., (1821–1865), Standring S., Ed. Gray's Anatomy: The Anatomical Basis of Clinical Practice. 39th ed., Churchill Livingstone, 2008, 1600 p., см.: Анатомия человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Наиболее вероятная структура гемациркуляторного русла гипоталамуса и гипофиза. Артерии гипофиза исходят от каждой внутренней сонной артерии по одиночной нижней гипофизарной артерии и по нескольким верхним гипофизарным артериям. Нижняя гипофизарная артерия разделяется на медиальную и латеральную ветви. В нейрогипофизе эти артериальные ветви образуют два типа гемакапиллярных сетей. В первом типе гемакапиллярных сетей приносящими и выносящими сосудами являются артериолы. Такой тип сетей называется артериально-артериальным микрогемациркуляторным руслом. Во втором типе гемакапиллярных сетей нейрогипофиза приносящим сосудом является артериола, а выносящим сосудом является венула. Такой тип сетей называется артериально-венозным микрогемациркуляторным руслом. По венулам артериально-венозного микрогемациркуляторного русла кровь оттекает по трём направлениям. Первое направление потока крови - в нижние гипофизарные вены, а далее в синусы твёрдой оболочки головного мозга. Второе направление потока крови - в длинные и короткие вены и венулы аденогипофиза. Венулы аденогипофиза дают начало его венозноно-венозному микрогемациркуляторному руслу. Выносящими сосудами этой гемакапиллярной сети являются нижние гипофизарные вены аденогипофиза. Третье направление потока венозной крови - от гемакапиллярной сети нижней части воронки (артериально-венозное гемациркуляторное русло). Приносящими сосудами этой сети являются верхние гипофизарные артерии. Кроме того, верхние гипофизарные артерии являются приносящими сосудами, проходящими по оси воронки серого бугра, образующими анастомозы с выносящими нижними гипофизарными артериями. Эти анастомозы образуют гемакапиллярную сеть (артериально-артериальное гемациркуляторное русло) воронки. Верхние гипофизарные артерии снабжают кровью срединное возвышение и образуют в верхней части воронки гемакапиллярную сеть (артериально-венозное гемациркуляторное русло).
Артерии срединного возвышения и стока воронки завершаются характерной сетью капилляров, которая наиболее сложна в верхней части воронки. В срединном возвышении капилляры образуют наружное, «покровное» сплетение капилляров и внутреннее, «глубокое» сплетение капилляров. В гемакапилляры наружного сплетения кровь поступает от верхних гипофизарных артерий, а оттекает по длинным прямым венам. Прямые вены нисходят в переднюю долю гипофиза (аденогипофиз). Внутреннее гемакапиллярное сплетение образовано параллельными цепями наружного гемакапиллярного сплетения. От капилляров нижней части воронки, от её стока кровь оттекает по коротким прямым венам в переднюю долю гипофиза. Как длинные, так и короткие прямые вены впадают в венозные синусоиды, расположенные в тяжах, разделяющих островки секреторных клеток аденогипофиза. Аденогипофиз не снабжается непосредственно артериями. Поскольку как приносящие гемасосуды, так и выносящие гемасосуды аденогипофиза являются однотипными, в частности венами, гемациркуляторное русло аденогипофиза по определению является воротным (портальным) гемациркуляторным руслом, а кровообращение по этим сосудам - воротной (портальной) системой гемациркуляции. Воротная система гемациркуляции предназначена для транспорта либеринов и статинов гипоталамуса. Эти гормоны синтезируются и выводятся мелкими (парвоцеллюлярными) нейросекреторными клетками, сгруппироваными в гипоталамусе. Гипоталамические либерины и статины управляют секреторными циклами аденогипофиза. Промежуточная часть гипофиза не имеет чётко организованного кровоснабжения.
Существует три возможных пути венозного кровотока в гипофизе. Первый путь: приток по длинным и коротким прямым (портальным, воротным) венам. Второй путь: отток по крупным нижним гипофизарным венам в венозные синусы твёрдой мозговой оболочки. Третий путь: отток к гипоталамусу от сети капилляров, расположенных в срединном возвышении. Венозный кровоток предназначен для переноса гормонов от гипофиза к органам-мишеням и клеткам-мишеням. Эти гормоны являются средством управления секрецией (положительная обратная связь). Следует иметь в виду, что гемациркуляция в гипофизе не является полностью изолированной от системного гемациркуляторного русла. Небольшое число вен, участвующих в кровообращении гипофиза, непосредственно связано с венами системного гемациркуляторного русла. |
|
|
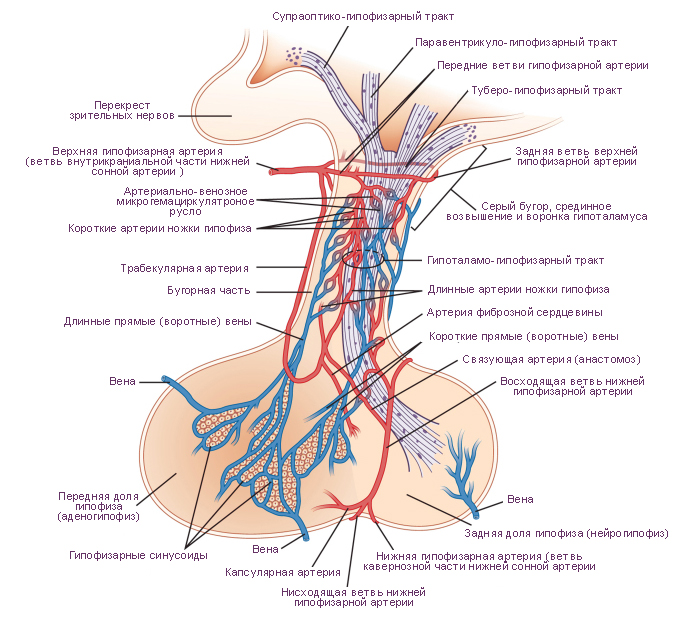
Схема. Гемациркуляторное русло гипоталамуса и гипофиза. Сагиттальное сечение мозга. Вид слева.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Гипофиз - это эндокринная железа, состоящая из трёх частей: передняя доля гипофиза (~70 ÷ 80 % всей массы гипофиза), задняя доля гипофиза и промежуточная (рудиментарная) доля гипофиза. Гипофиз расположен в гипофизарной ямке турецкого седла клиновидной кости черепа. Железа отделена от полости черепа отростком твёрдой оболочки головного мозга, образующим диафрагму седла. Через отверстие в этой диафрагме гипофиз посредством ножки соединен с вышележащими отделами головного мозга: с воронкой гипоталамуса, с медианным возвышением гипоталамуса промежуточного мозга. Поперечный размер гипофиза ~10 ÷ 17 мм, переднезадний - ~5 ÷ 15 ÷ мм, вертикальный ~5 ÷ 10 мм. Масса гипофиза (~400 ÷ 900 г). У мужчин среднее значение массы гипофиза составляет ~0,5 г, у женщин - ~0,6 г. Поперечное среднее значение диаметра гипофиза составляет ~13 мм. Вертикальный размер - ~6 ÷ 9 мм. Переднезадний размер - ~9 мм. Эти размеры могут изменяться у женщин во время менструального цикла и различаться у неоднократно рожавших женщин. Во время беременности эти размеры могут увеличиваться во всех направлениях. Соответственно увеличивается масса гипофиза до ~1 г. Снаружи гипофиз покрыт капсулой.
Передняя доля гипофиза, или аденогипофиз более плотная, чем задняя доля, нейрогипофиз. В передней доле выделяют три части. Дистальная (передняя) часть аденогипофиза занимает переднюю область гипофизарной ямки турецкого седла черепа. Промежуточная часть аденогипофиза расположена на границе с задней долей гипофиза. Бугорная (туберальная) часть аденогипофиза расположена выше и соединяется с воронкой и медианным возвышением гипоталамуса.
В связи с особенностями кровоснабжения частей гипофиза, передняя доля имеет бледно-желтый цвет, с красноватым оттенком. Паренхима передней доли гипофиза представлена несколькими типами железистых клеток, расположенных скоплениями (трабекулами или фолликулами) разделёнными перегородками из рыхлой соединительной ткани. В толще перегородок располагаются синусоидальные кровеносные капилляры.
Задняя доля гипофиза (неирогипофиз) состоит из нейрональной части и воронки. Нейрональная часть находится в задней области гипофизарной ямки, располагающейся позади бугорной части аденогипофиза. Нейрогипофиз содержит нейроглиальные клетки (питуициты), нервные волокна, идущие в нейрогипофиз от нейросекреторных ядер гипоталамуса, и нейросекреторные тельца. |
|
|
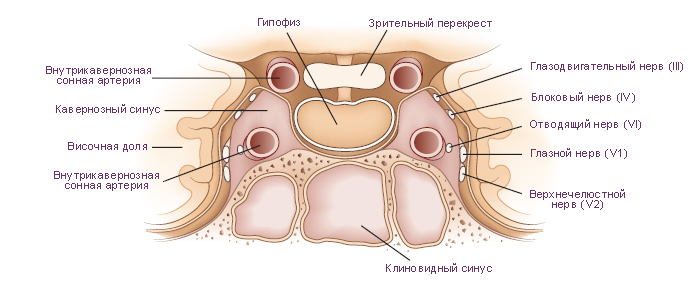
Схема. Поперечное сечение структур в облсти турецкого седла черепа.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
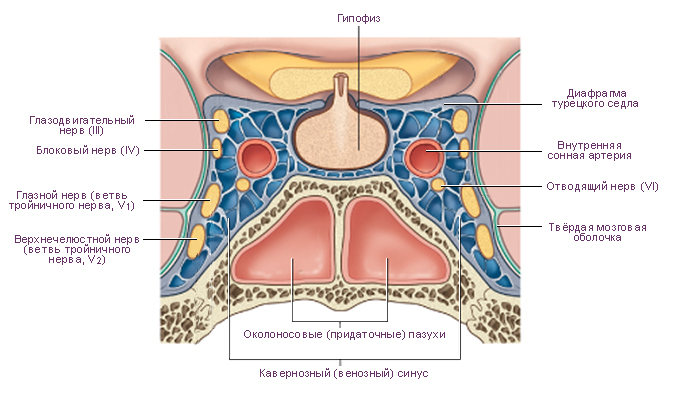
На верхней (мозговой) поверхности расположено углубление, которое называют турецким седлом. В центре турецкого седла имеется гипофизарная ямка. В ней размещается гипофиз. Латеральные стенки турецкого седла состоят из костной ткани или из ткани твёрдой мозговой оболочки и граничат с кавернозными синусами. Через отверстия в этих стенках проходят парные третий, четвёртый, шестой черепные нервы и внутренняя сонная артерия. Таким образом, при увеличении объёма содержимого области турецкого седла содержимое кавернозных синусов подвержено наибольшему влиянию давления. Крыша, образованная твёрдой мозговой оболочкой, демпфирует колебания давления цереброспинальной жидкости на гипофиз. Непосредственно выше диафрагмы турецкого седла и кпереди от ножки гипофиза расположен перекрест зрительных нервов (зрительный перекрест). Из-за такой топографии, зрительные тракты и соседние центральные структуры являются наиболее чувствительными к повышению давления при увеличении массы гипофиза. Такое давление может поднимать диафрагму турецкого седла, преодолевая её упругое сопротивление. |
|
|
Схема. Механизм обратной связи в каскаде многомиллионного усиления гормональных управляющих сигналов.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Информация о среде передаётся к регуляторам центральной нервной системы. Одним из таких регуляторов является гипоталамус. Нейросекреторные клетки гипоталамуса секретируют и выводят нанограммы специфических гормонов. Главными группами таких гормонов являются либерины (гормоны, способствующие высвобождению определённых гормонов) и статины (гормоны, препятствующие высвобождению специфических гормонов). Либерины и статины поступают в кровь закрытой гипоталамо-гипофизарной воротной системы и через гематоэнцефалический барьер проходят к специфическим эндокринным клеткам передней доли гипофиза. При взаимодействии с биохимическими рецепторами плазмалемм эндокринных клеткок передней доли гипофиза, они выделяют микрограммы специфических гипофизарных гормонов. Эти гормоны поступают в местное венозное микрогемациркуляторное русло, затем в системное гемациркуляторное русло. Связываясь со специфическими биохимическими рецепторами эндокринных желёз, они запускают выведение этими железами в кровь микрограмм/миллиграмм гормонов в сутки. В свою очередь, гормоны эндокринных желёз с кровью достигают периферических тканей-мишеней и обусловливают оптимальные реакции организма на воздействия среды.
На схеме стрелки с тёмными точками в их начале указывают на процессы секреции.
Кроме того, что нейросекреторные клетки гипоталамуса секретируют гормоны либерины и статины, предназначенные для управления передней долей гипофиза, они секретируют нейрогипофизарные гормоны задней долей гипофиза (окситоцин, вазопрессин).
В передней доле зрелого гипофиза имеется по крайней мере пять особых групп клеток, секретирующих гормоны. Клетки-кортикотрофы выделяют проопиомеланокортиновые (pro-opiomelanocortin,POMC) пептиды. В состав этой группы входит адренокортикотропный гормон (adrenocorticotropic hormone, ACTH). Клетки-тиреотрофы выделяют общую гликопротеиновую альфа-субъединицу (glycoprotein α-subunit) и специфическую бета-субъединицу - тиролиберин (thyroid-stimulating hormone, TSH, β-subunit). Клетки-гонадотрофы выделяют альфа- и бета-субъединицы(α- and β-subunits)
для фолликулостимулирующего гормона и лютеинизирующего гормона (follicle-stimulating hormone, FSH; luteinizing hormone, LH). Клетки-лактотрофы выделяют гормон пролактин. Структура и функции каждого типа этих клеток регулируются высокоспецифичными управляющими сигналами. |
|
|
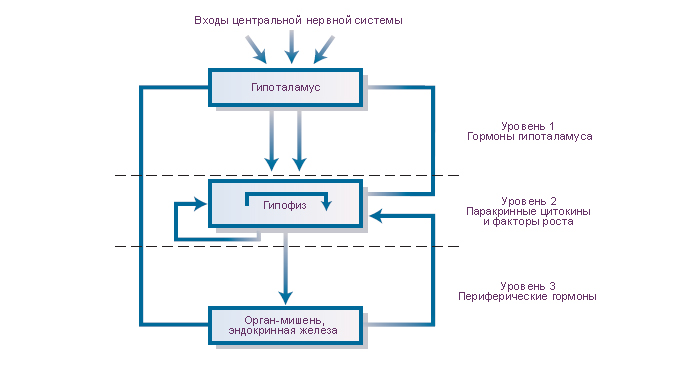
Схема. Трехуровневый механизм управления секреции аденогипофиза.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
В механизмах управления секрецией передней доли гипофиза можно выделить три уровня. (1) Средством управления секрецией аденогипофиза являются гипоталамические гормоны. Они выводятся в кровь гипоталамо-гипофизарной воротной системы, доставляются в переднюю долю гипофиза и взаимодействуют с биохимическими рецепторами плазмалемм его секреторных клеток. Эти биохимические рецепторы высоко специфичны каждому гипоталамическому гормону. Гипоталамические гормоны передают либо стимулирующие, либо тормозные управляющие сигналы для секреции и выведения гипофизарных тропных гормонов. (2) В модуляции секреции гипофизарных тропных гормонов участвуют (специфическая отрицательная обратная связь) гормоны периферических эндокринных желёз. (3) Гипофизарные паракринные и аутокринные факторы роста и цитокины являются средствами локального регулирования структуры и функций соседних клеток.
Общим результатом реализации этих трёх механизмов является секреция квантов шести гипофизарных тропных гормонов: адренокортикотропный гормон, гормон роста, пролактин, тиреотропный гормон, фолликулстимулирующий гормон и лютеинизирующий гормон. Тропные гормоны выводятся с кровью через кавернозные синусы, каменистые вены, верхнюю полую вену в системную гемациркуляцию. Управление секрецией гормонов гипофиза критически важно для интеграции функций периферических эндокринных желёз, которые, в свою очередь являются средством гуморального управления многими функциями организма. |
|
|
|
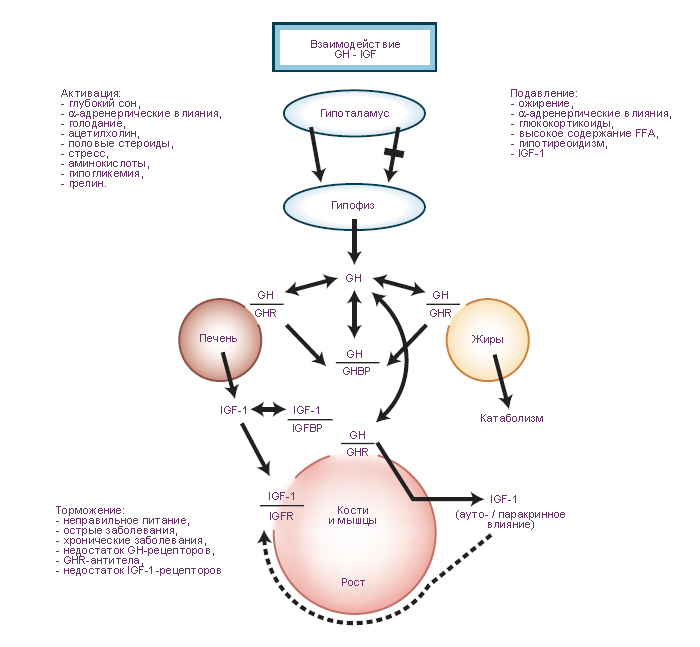
Схема. Последовательность реакций, вызванных гормоном роста. Взаимодействие гормона роста с соматомедином.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
GH, growth hormone = гормон роста;
GHBP, GH-binding protein = циркулирующий с кровью гормон роста, связанный транспортным белком;
GHRH, growth hormone-releasing hormone = соматолиберин;
IGF-1, insulin-like growth factor 1, also called somatomedin C = инсулиноподобный фактор роста-1, или то же что соматомедин - биоактивный белок печени и мышц, посредник гормона роста.
IGFR, IGF-1 receptor = рецептор соматомедина (инсулиноподобный фактор роста-1);
FFA, free fatty acids = свободные жирные кислоты;
SRIF, somatostatin = соматостатин. |
|
|
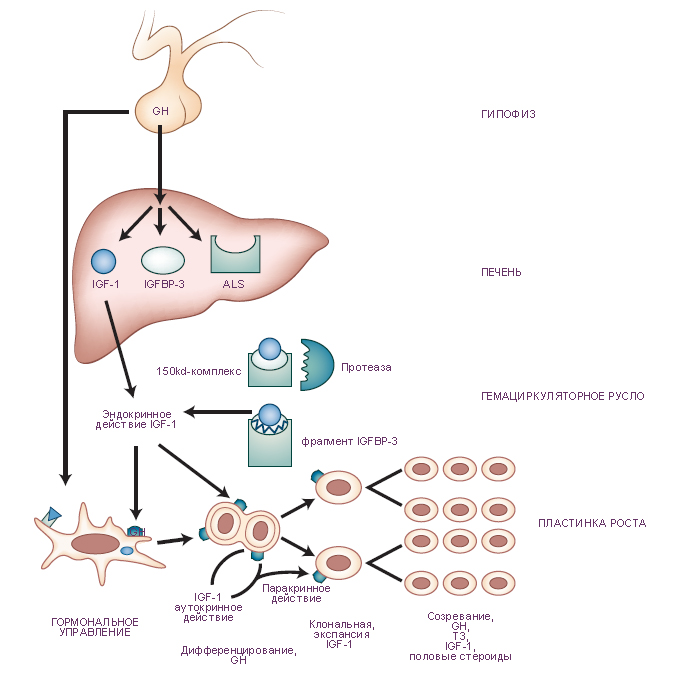
Схема. Гипотетические механизмы гормонального управления процессами роста.
Взаимодействие: гормон роста - соматомедин, связанный с белком - инсулиноподобный фактор роста.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Предполагается существованиt трех возможных механизмов гормонального управления процессами роста.
В соответствии с первой гипотезой гормон роста (growth hormone, GH) стимулирует выработку инсулиноподобного фактора роста-1 (соматомедин, insulin-like growth factor 1, IGF-1). Повышение концентрации соматомедина в циркулирующей крови (эндокринный соматомедин) действует на эпифизеальную пластинку (пластинка роста, гиалиновая пластинка хряща в метафизах длинных костей).
В соответствии со второй гипотезой гормон роста регулирует выработку клетками печени: (а) связанного с белком соматомедина-3 (IGF-binding protein 3, IGFBP-3) и кислотно-лабильных субъединиц (acid-labile subunit, ALS) комплекса белок-соматомедин (IGFBP complex). Соматомедин связывается с кислотно-лабильными субъединицами комплекса белок-соматомедин. При этом образуется трёхкомпонентные комплексы (150-kd ternary complex). В последующем протеазы расщепляют эти комплексы на фрагменты, высвобождающие в гемациркуляторное русло связанный с белком соматомедин-3 и инсулиноподобноый фактор роста-1, действующие на эпифизеальную пластинку.
В соответствии со третьей гипотезой гормон роста вызывает дифференцирование и местную выработку инсулиноподобного фактора роста-1 (соматомедин). По паракринному и аутокринному механизму соматомедин стимулирует деление клеток. T3, triiodothyronine = трииодтиронин. |
|
|
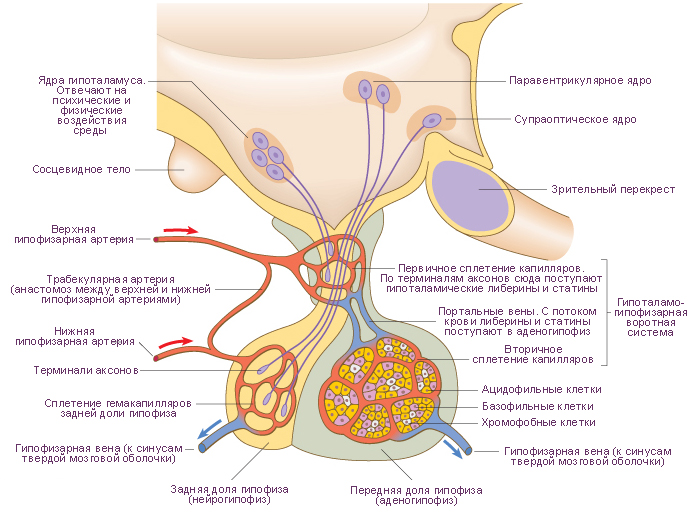
Схема. Главные средства управления эндокринной секреторной активностью гипофиза.
Модификация: Gray H., (1821–1865), Standring S., Ed. Gray's Anatomy: The Anatomical Basis of Clinical Practice. 39th ed., Churchill Livingstone, 2008, 1600 p., см.: Анатомия человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
В гипофизе выделяют две доли: передняя доля гипофиза (аденогипофиз) и задняя доля гипофиза (нейрогипофиз).
1. Передняя доля гипофиза. Переднюю долю гипофиза разделяют на три части: (а) передняя часть аденогипофиза, (б) промежуточная часть аденогипофиза, (в) туберальная часть аденогипофиза.
(а) Передняя часть аденогипофиза образована скоплениями эпителиальных клеток, образующих разветвленные тяжи - трабекулы, а также нерегулярные фолликулы. В промежутках между скоплениями клеток расположены синусоидальные кровеносные капилляры. Тонкие стенки синусоидов образованы рыхлой волокнистой соединительной тканью. Трабекулы и фолликулы содержат железистые клетки - эндокриноциты.
Различают три типа эндокриноцитов трабекул. Эндокриноциты, располагающиеся по периферии клеточных скоплений, содержат в своей цитоплазме секреторные гранулы, которые легко окрашиваются. В связи с этим такие клетки именуются хромофильными эндокриноцитами. Эндокриноциты, занимающие середину клеточного скопления, имеют нечеткие границы, поскольку их цитоплазма слабо окрашивается. Такие клетки именуются хромофобными эндокриноцитами.
Секреторные гранулы хромофильных эндокриноцитов могут окрашиваться либо основными, либо кислыми красителями. В соответствии с этим хромофильные эндокриноциты разделяют на базофильные и ацидофильные. Гранулы эндокриноцитов содержат гликопротеиды, являющиеся материалом для биосинтеза гормонов. Сравнительно крупные базофильные эндокриноциты в норме составляют ~4 ÷ 10 % общего количества аденоцитов. Выделяют две разновидности базофильных эндокриноцитов.
Клетки первой разновидности характеризуются округлой или овальной формой и эксцентрическим положением ядер. Их секреторные гранулы имеют диаметр ~200 ÷ 300 нм. Количество базофильных эндокриноцитов увеличивается при интенсивной выработке гонадотропных гормонов (гонадотропинов). В связи с этим такие клетки называются гонадотропоцитами, или гонадотропными эндокриноцитами. Одни из гонадотропоцитов вырабатывают фолликулостимулирующий гормон (фоллитропин), а другие - лютеинизирующий гормон (лютропин). Фоллитропин является средством управления формированием половых клеток. Лютропин является стимулирующим средством управления образованим жёлтого тела в яичнике, а также средством управления выработкой мужского полового гормона интерстициальными клетками яичка.
Базофильные клетки второй разновидности отличаются неправильной формой. Их секреторные гранулы очень мелкие (диаметр ~80 ÷ 150 нм) и легко окрашиваются альдегид-фуксином. Эти гранулы содержат меньше гликопротеинов, чем гранулы гонадотропоцитов. Клетки второй разновидности вырабатывают тиротропный гормон - тиротропин. Тиротропин является стимулирующим средством управления функциями фолликулярных эндокриноцитов щитовидной железы. Отсюда, клетки секретирующие тиротропин называются тиротропоцитами, или тиротропными эндокриноцитами.
Ацидофильные эндокриноциты содержат крупные плотные белковые гранулы, которые легко окрашиваются кислыми красителями. По размерам эти клетки несколько меньше базофильных эндокриноцитов. Их количество составляет ~30 ÷ 35 % всех аденоцитов передней доли гипофиза. Они имеют округлую или овальную форму. Ядра базофильных эндокриноцитов располагаются в центре клетки. У них хорошо развита гранулярная эндоплазматическая сеть. Ацидофильные эндокриноциты также имеют две разновидности. Первая разновидность ацидофильных эндокриноцитов - соматотропоциты, или соматотропные эндокриноциты. Одни соматотропоциты вырабатывают гормон роста, или соматотропин. Соматотропин является средством управления ростом организма. Другие соматотропоциты вырабатывают лактотропный гормон, или пролактин и потому их называют соответственно маммотропоцитами, или маммотропными эндокриноцитами и пролактиноцитами, или пролактотропными эндокриноцитами. Лактотропный гормон (пролактин) является средством управления биосинтезом молока в молочной железе. Интенсивность секреции пролактина усиливается у рожени́ц после родов, во время лактации и вскармливания новорожденного. Кроме того, пролактин продлевает существование и функции желтого тела в яичнике. Секреторные гранулы соматотропоцитов имеют шаровидную форму. Их диаметр составляет ~350 ÷ 400 нм. Маммотропоциты отличаются еще более крупными гранулами овальной или удлиненной формы (длина ~500 ÷ 600 нм, ширина ~100 ÷ 120 нм).
Хромофильные эндокриноциты включают ещё одну группу клеток, расположенных главным образом в центральной части передней доли гипофиза. Эти клетки называют кортикотропными эндокриноцитами, или кортикотропоцитами. Они вырабатывают адренокортикотропный гормон (АКТГ, или кортикотропин). Адренокортикотропный гормон является стимулирующим средством управления секрецией гормонов клетками пучковой зоны коркового вещества надпочечников. Кортикотропоциты имеют неправильную форму, дольчатые ядра, хорошо развитую эндоплазматическую сеть. Их секреторные гранулы имеют строение пузырьков, содержащих в своей полости плотную белковую сердцевину. Между мембраной пузырька и его сердцевиной остается светлое пространство.
Хромофобные клетки составляют ~60 % общего числа аденоцитов. Цитоплазма хромофобных эндокриноцитов слабо окрашивается. В ней не видны секреторные гранулы. Хромофобные клетки имеют разную степень развития и выполняют различные функции. Среди них существуют клетки, уже начавшие специализироваться в базофильные или ацидофильные клетки, но еще не успевшие накопить специфические секреторные гранулы. Другие же, хромофобные клетки, наоборот, являются вполне специализированными, но лишившимися своих базофильных или ацидофильных секреторных гранул вследствие интенсивной или длительной секреции. Небольшое количество неспециализированных хромофобных клеток относят к резервным клеткам.
Среди хромофобных клеток встречаются звездчатые (фолликулозвездчатые) клетки. Это клетки небольшого размера, имеющие длинные ветвистые отростки, посредством которых они соединяются в широкопетлистую сеть. Некоторые из отростков проходят между соседними эндокриноцитами и заканчиваются на стенках синусоидных капилляров. Иногда звездчатые клетки группируются в небольшие фолликулы. В полостях этих фолликулов накапливается гликопротеидный секрет. На апикальных поверхностях таких звездчатых клеток (со стороны просвета фолликула) имеются микроворсинки.
Функции аденогипофиза управляются посредством пептидов и аминов, секретируемых нейронами гипоталамуса. Эти нейросекреторные клетки расположены главным образом в медиальной зоне гипоталамуса, в его дугообразном ядре, в медиальной парвоцеллюлярной части паравентрикулярного и перивентрикулярного ядер.
(б) Средняя (промежуточная) часть аденогипофиза представляет собой узкую полоску эпителия. Эндокриноциты средней части способны вырабатывать белковый или слизистый секрет, который, накапливаясь между соседними клетками, приводит к формированию в средней части аденогипофиза фолликулоподобных кист. От задней части аденогипофиза эпителий средней части отделяется тонкой прослойкой рыхлой соединительной ткани.
Эндокриноциты средней части аденогипофиза вырабатывают меланоцитостимулирующий гормон (меланоцитотропин), а также липотропин - гормон, являющийся средством управления метаболизмом липидов.
(в) Туберальная часть аденогипофиза прилежит к ножке гипофиза и соприкасается с нижней поверхностью медианного возвышения гипоталамуса. Туберальная часть образована эпителиальными тяжами, состоящими из кубических клеток с умеренно базофильной цитоплазмой. От туберальных тяжей в переднюю часть аденогипофиза, так же как от эпителия средней части, отходят трабекулы. В некоторых клетках туберальных тяжей встречаются базофильные гранулы.
Кровоснабжение гипоталамуса и гипофиза выполняет функцию реализации управления аденогипофизарного гормонопоэза.
2. Задняя доля гипофиза (нейрогипофиз). Задняя доля гипофиза содержит в основном клетки эпендимы. Они имеют отростчатую или веретеновидную форму и называются питуицитами задней доли гипофиза. Их многочисленные тонкие отростки заканчиваются в адвентиции кровеносных сосудов или на базальной мембране гемакапилляров.
В задней доле гипофиза накапливаются антидиуретический гормон (вазопрессин) и окситоцин. Гормоны вазопрессин и окситоцин вырабатываются крупными пептидохолинергическими нейросекреторными клетками переднего гипоталамуса. Вазопрессин является средством управления реабсорбцией в мочевых канальцах почки. Окситоцин является средством управления сокращением мускулатуры матки. Аксоны нейросекреторных клеток переднего гипоталамуса собираются в гипоталамо-нейрогипофизарные пучки, входят в заднюю долю гипофиза, где заканчиваются крупными терминалями (тельца Херринга, или накопительные тельца), на стенках гемакапилляров.
Percy Theodore Herring (1872-1967), физиолог, врач, Великобритания. |
|
|
Схема. Гипофиз и окружающие его структуры. Кавернозный синус. Срединное фронтальное сечение мозга человека.
Модификация: Gray H., (1821–1865), Drake R., Vogl W., Mitchell A., Eds. Gray's Anatomy for Students. Churchill Livingstone, 2007, 1150 p., см.: Анатомия человека: Литература. Иллюстрации.
|
 |
|
|
Схема. Структуры головного мозга, расположенные вокруг третьего и четвёртого желудочков. Срединное сечение мозга человека.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Закрашены светлокоричневым цветом - рассечённые структуры: зрительный перекрест, мозолистое тело, передняя спайка, задняя спайка.
Закрашены тёмнокоричневым цветом:
AP, Area postrema - конечная (самая задняя) область продолговатого мозга (каудальный отдел третьего желудочка);
ME, median eminence - срединное возвышение серого бугра гипоталамуса;
NH, neurohypophysis - задняя доля гипофиза (нейрокипофиз);
OVLT, organum vasculosum of the lamina terminalis - гемасосудистый орган терминальной пластинки гипоталамуса;
PI, pineal body - шишковидное тело;
SFO, subfornical organ - субфорникальный (подсводный) орган; SCO, subcommissural organ - субкомиссуральный (подспаечный) орган;
CP, choroid plexus - сосудистое сплетение третьего желудочка. |
|
|
Схема. Три типа нейросекреторных клеток гипоталамуса.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Левая треть схемы. Крупные нейроны (magnicellular neuron) секретируют вазопрессин (vasopressin, AVP) и окситоцин (oxytocin, OXY). Тела этих секреторных нейронов расположены в супраоптических (supraoptic hypothalamic nucleus, SON) и/или паравентрикулярных (paraventricular hypothalamic nucleus, PVH) ядрах гипоталамуса. Синтезируемые нейросекреты по аксонам этих нейронов транспортируются в заднюю долю гипофиза (нейрогипофиз) и выделяются терминалями аксонов.
Центральная треть схемы. Подобные описанным выше нейронам, пептидергические нейроны расположены в медиальной части основания гипоталамуса в группах ядер: перивентрикулярные ядра гипоталамуса (periventricular hypothalamic nucleus, PeVH), паравенттрикулярные ядра гипоталамуса (paraventricular hypothalamic nucleus, PVH) и дугообразное ядро гипоталамуса (arcuate nucleus of the hypothalamus, Arc). Секретируемые нейропептиды выводятся в специализированное гемациркуляторное русло гипофиза. Эти нейропептиды являются средством управления секрецией гипофиза.
Правая треть схемы. Другие пептидергические нейроны гипоталамуса своими отростками образуют химические синапсы на других нейронах гипоталамуса. Такие синапсы обнаружены в PVH, Arc и в латеральной области гипоталамуса (lateral hypothalamic area, LHA). Эти структуры взаимодействуют с нейронами многих ядер нервной системы, в том числе с вегетативными предганглионарными нейронами ствола головного мозга и спинного мозга. Синаптические трансмиттеры этих нейронов являются нейромедиаторами или нейромодуляторами.
Обозначения:
ACTH, сorticotropin - кортикотропин;
CART, cocaine- and amphetamine-regulated transcript - кокаин- и амфетамин-регулирующий транскрипт;
CRH, corticotropin-releasing hormone - кортиколиберин;
FSH, follicle-stimulating hormone - фоллиберин;
GH, growth hormone - гормон роста;
GHRH, growth hormone-releasing hormone соматолиберин;
GnRH, gonadotropin-releasing hormone - гонадолиберин;
LH, luteinizing hormone - люлиберин;
MCH, melanin-concentrating hormone - меланолиберин;
ORX, orexin/hypocretin - орексин/гипокретин;
POMC, pro-opiomelanocortin - проопиомеланокортин;
TRH, thyrotropin-releasing hormone - тиролиберин;
TSH, thyrotropin - тиротропин. |
|
|
Схема. Отношения гипоталамуса, гипофиза и щитовидной желзы в управлении секрецией тиреоидных гормонов.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
AGRP, agouti-related protein - агути-родственный белок;
CART, cocaine- and amphetamine-regulated transcript - кокаин- и амфетамин-регулирующий транскрипт;
CRH, corticotropin-releasing hormone - кортиколиберин;
NPY, neuropeptide Y - нейропептид-Y;
POMC, proopiomelanocortin - проопиомеланокортин;
T3, triiodothyronine - трииодтиронин;
T4, thyroxine - тироксин;
TRH, thyrotropin-releasing hormone - тиролиберин;
TSH, thyrotropin - тиротропин. |
|
|
Схема. Отношения гипоталамуса, гипофиза и надпочечников в управлении секрецией гормонов надпочечников.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
ACTH, Adrenocorticotropic hormone - адренокортикотропный гормон;
AVP, arginine vasopressin;
BST, bed nucleus of the stria terminalis - ядро ложа концевой полоски;
CNS, central nervous system - центральная нервная система;
CRH, corticotropin-releasing hormone - кортиколиберин;
CRIF, corticotropin release-inhibiting factor - кортикостатин;
GABA, γ-aminobutyric acid;
5-HT, 5-hydroxytryptamine - 5-гидрокситриптамин (серотонин);
IL-1, interleukin-1 - интерлейкин-1;
MeA, medial amygdala - медиальная часть миндалевидного тела;
MePO, medial preoptic - медиальная часть предоптической области гипоталамуса;
NPY, neuropeptide Y - нейропептид-Y;
NTS, nucleus of the tractus solitarius - ядро одиночного пути;
OVLT, organum vasculosum of the lamina terminalis - гемасосудистый орган терминальной пластинки гипоталамуса;
POMC, pro-opiomelanocortin - проопиомеланокортин.
|
|
|
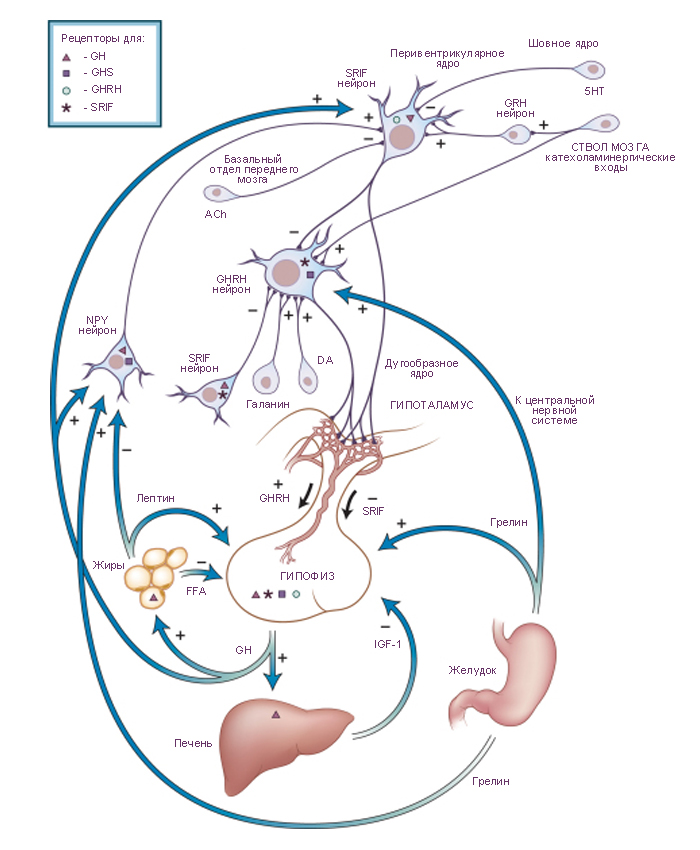
Схема. Отношения гипоталамуса и гипофиза в управлении секрецией гормона роста.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Секреция гормона роста (GH, growth hormone) гипофизом активируется соматолиберином (GH-releasing hormone, GHRH) и тормозится соматостатином (somatostatin, SRIF). На уровне гипофиза существует управление секрецией гормона роста посредством инсулиноподобного фактора роста-1 (insulin-like growth factor I, IGF-I) и посредством свободных жирных кислот (free fatty acids, FFA). Гормон роста также активирует нейроны (SRIF neurons) перивентрикулярного ядра гипоталамуса, секретирующих соматостатин. Таким образом реализуется механизм короткой отрицательной обратной связи в управлении секрецией гормона роста. Аксоны нейронов, секретирующих соматостатин, заканчиваются синапсами на нейронах (GHRH neurons) дугообразного ядра, вырабатывающих соматолиберин и посылающих свои аксоны к срединному возвышению гипоталамуса. Нейроны дугообразного ядра также непосредственно модулируют секрецию гормона роста по интегрированным сигналам периферического гормона роста, лептина и грелина. Эти нейроны дугообразного ядра, вырабатывают нейропептид-Y (neuropeptide Y, NPY neurons) и реализуют его к перивентрикулярным нейронам (periventricular SRIF neurons), секретирующим соматолиберин. Грелин секретируется в желудке и является гипофизарным естественным лигандом для биохимических рецепторов, участвующих в активации секреции гормона роста, как на гипоталамическом, так и на гипофизарном уровне. Установлено, что выведение соматолиберина активируется галанином, γ-аминомасляной кислотой (γ-aminobutyric acid, GABA), и α-2-адренергическими и дофаминергическими (DA, dopamine) сигналами, но тормозится соматостатином. Секреция соматостатина тормозится ацетилхолином (ACh, acetylcholine, мускариновые рецепторы) и 5-гидрокситриптамином (серотонин, 5-HT, 5-hydroxytryptamine, рецепторы типа-1D). Секреция соматостатина активируется α-2-адренергическими сигналами и кортиколиберином. |
|
|
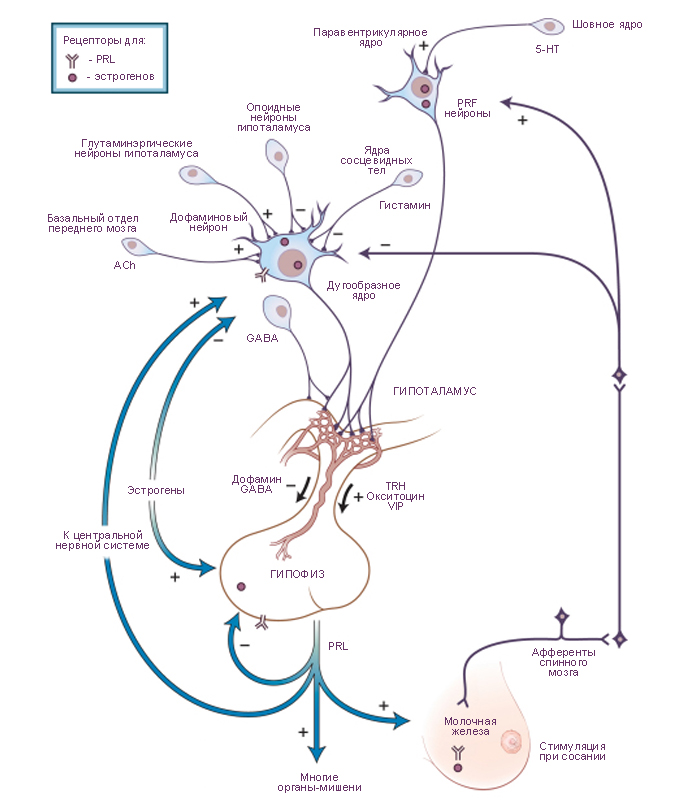
Схема. Отношения гипоталамуса и гипофиза в управлении секрецией пролактина.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
Преимущественное тормозное влияние гипоталамуса на секрецию пролактина запускается дофамином, секретируемого совокупностью дофаминергических нейронов туберогипофизальной области. Дофаминергические нейроны стимулируются ацетилхолином (acetylcholine, ACh) и глютаматом, но тормозятся гистамином и опоидными пептидами. Немедленное выведение пролактина при сосании или стрессе запускается одним или несколькими пролактолиберинами (prolactin-releasing factors, PRFs). Существует несколько таких пролактолиберинов. Среди них: тиролиберин (thyrotropin-releasing hormone, TRH), тонкокишечный вазоактивный пептид (vasoactive intestinal polypeptide, VIP) и окситоцин (oxytocin). Нейроны, секретирующие пролактолиберин, активируются серотонином (5-HT). Секреция пролактина также управляется эстрогенами (ультракороткая петля обратной связи). Эстрогены кроме того влияют на секрецию гонадотропина и подавляют выведение люлиберина (luteinizing hormone-releasing hormone, LHRH). В свою очередь пролактин по механизму короткой обратной связи влияет на гипоталамический синтез и секрецию дофамина. GABA, γ-aminobutyric acid - гаммааминомасляная кислота. |
|
|
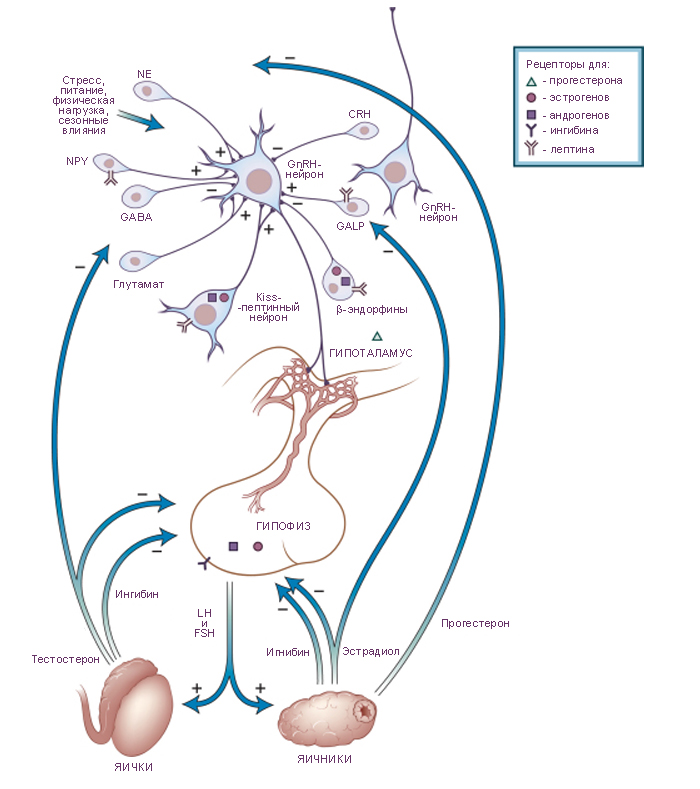
Схема. Отношения гипоталамуса, гипофиза и половых желёз в управлении секрецией половых гормонов.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
 |
|
Примечание:
|
GnRH, Gonadotropin-releasing hormone - гормон, высвобождающий гонадотропные гормоны;
CRH, Corticotropin-releasing hormone - гормон, высвобождающий кортикотропин;
FSH, follicle-stimulating hormone - фолликулстимулирующий гормон;
GABA, γ-aminobutyric acid - гаммааминомасляная кислота;
GALP, galanin-like peptide - галанин-подобный пептид;
LH, luteinizing hormone - лютеинизирующий гормон;
NPY, neuropeptide Y - нейропептид-Y.
Kiss-пептин (Kisspeptin, старое название Metastin) - обозначение G-белка, производного гена Kiss1. Kiss1 - произвольное название, не относящееся ни к сущности данного вещества, ни к имени первооткрывателя. |
|
Таблица. Нейротрансмиттеры и нейромодуляторы нейросекреторных клеток паравентрикулярного ядра и дугообразного ядра гипоталамуса.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации. |
Paraventricular Nucleus |
Arcuate Nucleus |
Magnicellular Division:
• Angiotensin II
• Cholecystokinin (CCK)
• Dynorphins |
• Acetylcholine
• γ-Aminobutyric acid (GABA)
• Agouti-related peptide (AGRP)
• Cocaine- and amphetamine-regulated transcript (CART) |
| Nitric oxide (NO) |
• Oxytocin
• Vasopressin |
• Dopamine
• Endocannabinoids
• Enkephalins
|
Parvicellular Divisions:
• γ-Aminobutyric acid (GABA)
• Angiotensin II
• Atrial natriuretic factor (ANF)
• Bombesin-like peptides
• Cholecystokinin (CCK)
|
• Galanin
• Galanin-like peptide (GALP)
• Glutamate
• Gonadotropin-releasing hormone (GnRH)
• Growth hormone–releasing hormone (GHRH)
• Kisspeptins
|
| Corticotropin-releasing hormone (CRH) |
• Dopamine
• Endocannabinoids
• Enkephalins
• Galanin
• Glutamate
• Interleukin-1 (IL-1)
• Neuropeptide Y (NPY)
• Neurotensin
|
• Neuromedin U
• Neuropeptide Y (NPY)
• Neurotensin
• Nociceptin/orphanin FQ (OFQ)
• Pancreatic polypeptide
• Prolactin
• Pro-opiomelanocortin
• Melanocortins (ACTH, α-MSH, β-MSH, γ-MSH)
|
• Nitric Oxide (NO)
• RFRP (RF amide-related peptides)
• Somatostatin
|
• Opioids (β-endorphin)
• QRFP (pyro-glutamyl-RFamide peptide)
• Somatostatin
|
• Thyrotropin-releasing hormone (TRH)
• Vasopressin
• Vasoactive intestinal peptide (VIP)
|
• Substance P
|
|
|
Таблица. Оценка функций аденогипофиза. c. 218.
Модификация: Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology, 12th ed., Saunders, 2011, 1816 p., см.: Физиология человека: Литература. Иллюстрации.
|
| № |
Test* |
Dose |
Normal Response |
Side Effects |
| Адренокортикотропный гормон; adrenocorticotropic hormone, ACTH |
| 1 |
Insulin tolerance |
0.1-0.15 U/kg IV |
Peak cortisol response >18 μg/dL, or ↑
≥ 5 μg/dL |
Sweating, palpitation, tremor |
| 2 |
Metyrapone |
30 mg/kg PO at 11 p.m. |
Peak 11-DOC ≥ 7 μg/dL
Peak cortisol ≤ 7 μg/dL
Peak ACTH >75 pg/mL |
Nausea, insomnia, adrenal crisis |
| 3 |
CRH stimulation |
100 μg IV |
Peak ACTH ≥ 2-4-fold
Peak cortisol ≥ 20 μg/dL or ↑ ≥ 7 μg/dL |
Flushing |
| 4 |
ACTH stimulation |
250 μg IV or IM, or 1 μg IV |
Peak cortisol ≥ 20 μg/dL |
Rare |
| Тиролиберин; thyroid-stimulating hormone, TSH |
| 5 |
Serum T4 (free T4)
Total T3
TSH—third generation
TRH stimulation |
200-500 μg IV |
Peak TSH ≥ 2.5-fold, or ↑ ≥ 5-6 mU/L
(females) or ≥ 2-3 mU/L (males) |
Flushing, nausea, urge to micturate |
| Пролактин; prolactin PRL |
| 6 |
Serum PRL
TRH stimulation |
200-500 μg IV |
PRL ↑ ≥ 2.5-fold |
Flushing, nausea, urge to micturate |
| Лютеинизирующий гормон / фолликулстимулирующий гормон; LH, luteinizing hormone / FSH, follicle-stimulating hormone |
| 7 |
Serum LH and FSH
Serum testosterone
GnRH Stimulation |
100 μg IV |
Elevated in menopause and in men with
primary testicular failure (otherwise
normal) 300-900 ng/mL
LH ≥ 2-3-fold, or ↑ by 10 IU/L
FSH ≥ 1.5-2-fold, or ↑ ≥ 2 IU/L |
Rare |
| Гормон роста; growth hormone, GH |
| 8 |
Insulin tolerance |
0.1-0.15 U/kg |
GH peak >5 мg/L |
Sweating, palpitation, tremor |
| 9 |
L-Arginine Arginine |
0.5 g/kg (maximum,
30 g) IV over 30-120 min |
GH peak >0.4 мg/L |
Nausea |
| plus |
| 10 |
GHRH |
GHRH 1-5 мg/kg |
GH peak >4 мg/L |
Flushing |
|
Обозначения. |
|
ACTH, adrenocorticotropic hormone;
CRH, corticotropin-releasing hormone;
11-DOC, 11-deoxycorticosterone;
FSH, follicle-stimulating hormone;
GH, growth hormone;
GHRH, growth hormone–releasing hormone;
GnRH, gonadotropin-releasing hormone;
|
LH, luteinizing hormone;
PRL, prolactin;
T3, triiodothyronine;
T4, thyroxine;
TSH, thyroid-stimulating hormone;
TRH, thyrotropin-releasing hormone.
|
Таблица. Лабораторные тесты для оценки функций гипоталамуса-гипофиза.
Модификация: Gardner D.G., Shoback D.M., Eds. Greenspan's Basic & Clinical Endocrinology. 9th ed., Lange, 2011, 960 p., см.: Физиология человека: Литература. Иллюстрации.
|
| № |
Название теста |
Метод |
Материал выборки |
Возможные побочные эффекты. Противопоказания |
Интерпретация |
| 1 |
Rapid ACTH stimulation test (cosyntropin test)
|
Administer synthetic ACTH (1-24) (cosyntropin), 250 g intravenously or intramuscularly. The test may be performed at any time of the day or night and does not require fasting. The low-dose test is performed in the same manner except that 1 g of synthetic ACTH (1-24) is administered.
|
Obtain samples for plasma cortisol at 0 and 30 min or at 0 and 60 min.
|
Rare allergic reactions have been reported.
|
A normal response is a peak plasma cortisol level > 18-20 g/dL (496-552 nmol/L).
|
| 2 |
Insulin hypoglycemia test
|
Give nothing by mouth after midnight. Start an intravenous infusion with normal saline solution. Regular insulin is given intravenously in a dose sufficient to cause adequate hypoglycemia (blood glucose <40 mg/dL). The dose is 0.1-0.15 unit/kg (healthy subjects); 0.2-0.3 unit/kg (obese subjects or those with Cushing syndrome or acromegaly); 0.05 unit/kg (patients with suspected hypopituitarism).
|
Collect blood for glucose determinations every 15 min during the study. Samples of GH and cortisol are obtained at 0, 30, 45, 60, 75, and 90 min.
|
A physician must be in attendance. Symptomatic hypoglycemia (diaphoresis, headache, tachycardia, weakness) is necessary for adequate stimulation and occurs 20-35 min after insulin is administered in most patients. If severe central nervous system signs or symptoms occur, intravenous glucose (25-50 mL of 50% glucose) should be given immediately; otherwise, the test can be terminated with a meal or with oral glucose. This test is contraindicated in the elderly or in patients with cardiovascular or cerebrovascular disease and seizure disorders.
|
Symptomatic hypoglycemia and a fall in blood glucose to <40 mg/dL (2.2 mmol/L) will increase GH to a maximal level > 5 ng/mL; some investigators regard an increment of 6 ng/mL (280 pmol/L) as normal. Plasma cortisol should increase to a peak level of at least 18-20 g/dL (496-552 nmol/L).
|
| 3 |
Metyrapone test
|
Metyrapone is given orally between 11 and 12 pm with a snack to minimize gastrointestinal discomfort. The dose is 30 mg/kg.
|
Blood for plasma 11-deoxycortisol and cortisol determinations is obtained at 8 am the morning after metyrapone is given.
|
Gastrointestinal upset may occur. Adrenal insufficiency may occur. Metyrapone should not be used in sick patients or those in whom primary adrenal insufficiency is suspected.
|
Serum 11-deoxycortisol should increase to > 7 g/dL (0.19 mol/L). Cortisol should be <10 g/dL (0.28 mol/L) in order to ensure adequate inhibition of 11-hydroxylation.
|
| 4 |
GHRH-arginine infusion test
|
The patient should be fasting after midnight. Give GHRH, 1 g/kg intravenously over 1 min followed by arginine hydrochloride, 0.5 g/kg intravenously, up to a maximum of 30 g over 30 min.
|
Blood for plasma GH determinations is collected at 0, 30, 60, 90, and 120 min.
|
Mild flushing, a metallic taste, or nausea and vomiting may occur. This test is contraindicated in patients with severe liver disease, renal disease, or acidosis.
|
The lower limit of normal for the peak GH response is 6 ng/mL (280 pmol/L) although most normals reach levels of > 10-15 ng/mL (460-700 pmol/L).
|
| 5 |
Glucagon stimulation test
|
The patient should be fasting after midnight. Give glucagon 1 mg intramuscularly.
|
Blood for plasma GH and capillary blood glucose at 0, 30, 60, 90, 120, 150, and 180 min.
|
Nausea and late hypoglycemia. This test is contraindicated in malnourished patients or patients who have not eaten for > 48 h.
|
GH rises to > 3 g/L in normal individuals. Glucose usually rises to peak around 90 min, then gradually declines.
|
| 6 |
Glucose growth hormone suppression test
|
The patient should be fasting after midnight; give glucose, 75-100 g orally.
|
GH and glucose should be determined at 0, 30, and 60 min after glucose administration.
|
Patients may complain of nausea after the large glucose load.
|
GH levels are suppressed to <2 ng/mL (90 pmol/L) in healthy subjects. Failure of adequate suppression or a paradoxic rise may be seen in acromegaly, starvation, protein-calorie malnutrition, and anorexia nervosa.
|
| 7 |
TRH test
|
Fasting is not required, but since nausea may occur, it is preferred. Give protirelin, 500 g intravenously over 15-30 s. The patient should be kept supine, since slight hypertension or hypotension may occur. Protirelin is supplied in vials of 500 g, although 400 g will evoke normal responses.
|
Blood for determination of plasma TSH and PRL is obtained at 0, 30, and 60 min. An abbreviated test utilizes samples taken at 0 and 30 min only. A maximum TSH response takes 45 min or less.
|
No serious complications have been reported. Most patients complain of a sensation of urinary urgency and a metallic taste in the mouth; other symptoms include flushing, palpitations, and nausea. These symptoms occur within 1-2 min of the injection and last 5 min at most.
|
Normal TSH response:
6 U/mL (6 mU/L) in women and men aged <49
2 U/mL( 2 mU/L) in men aged 40-79
Normal PRL response varies with gender and age.
|
| 8 |
GnRH test
|
The patient should be at rest but need not be fasting. Give GnRH (gonadorelin), 100 g intravenously, over 15 s.
|
Blood samples for LH and FSH determinations are taken at 0, 30, and 60 min. Since the FSH response is somewhat delayed, a 90-min specimen may be necessary.
|
Side effects are rare, and no contraindications have been reported.
|
This response is dependent on sex and the time of the menstrual cycle. Table 4–9 illustrates the mean maximal change in LH and FSH after GnRH administration. An increase of LH of 1.3-2.6 g/L (12-23 IU/L) is considered to be normal; FSH usually responds more slowly and less markedly. FSH may not increase even in healthy subjects.
|
| 9 |
Clomiphene test
|
Clomiphene is administered orally. For women, give 100 mg daily for 5 d (beginning on day 5 of the cycle if the patient is menstruating); for men, give 100 mg daily for 7-10 d.
|
Blood for LH and FSH determinations is drawn before and after clomiphene is given.
|
This drug may stimulate ovulation, and women should be advised accordingly.
|
In women, LH and FSH levels peak on the fifth day to a level above the normal range. After the fifth day, LH and FSH levels decline. In men, LH should double after 1 wk; FSH will also increase, but to a lesser extent.
|
| 10 |
CRH test
|
CRH (1 g/kg) is given intravenously as a bolus injection.
|
Blood samples for ACTH and cortisol are taken at 0, 15, 30, and 60 min.
|
Flushing often occurs. Transient tachycardia and hypotension have also been reported.
|
The ACTH response is dependent on the assay utilized and occurs 15 min after CRH is administered. The peak cortisol response occurs at 30-60 min and is usually > 10 g/dL (276 nmol/L).
|
| 11 |
Low-dose dexamethasone suppression test
|
Dexamethasone (1 mg) is given between 11 pm and midnight.
|
Blood samples for cortisol and dexamethasone are taken at 8 am the next morning.
|
Side effects are rare. Compliance is sometimes an issue. Some medications and patient variability can affect dexamethasone metabolism.
|
Cortisol should suppress to <1.8 g/dL in normal individuals. This cutoff has a high sensitivity, but specificity is compromised.
|
|
Примечание:
|
Endocrinologic Evaluation of the Hypothalamic-Pituitary Axis
The precise assessment of the hypothalamic-pituitary axis has been made possible by radioimmunoassays of the major anterior pituitary hormones and their specific target gland hormones. In addition, provocative testing using synthetic or purified hormones (eg, ACTH, ovine CRH, glucagon, insulin) can be used to assess hypothalamic-pituitary reserve and excess.
This section describes the principles involved in testing each pituitary hormone as well as special situations (eg, drugs, obesity) that may interfere with pituitary function or pituitary testing. Specific protocols for performing and interpreting diagnostic procedures are outlined at the end of this section and in Table 4–9. The clinical manifestations of either hypo- or hypersecretion of anterior pituitary hormones are discussed in subsequent sections.
|
Таблица. Некоторые исторические факты развития эндокринологии за последние 100 лет = Some landmarks in endocrinology over the last 100 years or so.
Модификация: Holt R.I.G., Neil A., Eds. Essential Endocrinology and Diabetes. 6th ed., Wiley, 2012, 390 p., см.: Физиология человека: Литература. Иллюстрации. |
| № |
Дата |
Открытия |
| 1 |
1905 |
First use of the term ‘hormone’ by Starling in the Croonian Lecture at the Royal
College of Physicians |
| 2 |
1909 |
Cushing removed part of the pituitary and saw improvement in acromegaly |
| 3 |
1914 |
Kendall isolated an iodine-containing substance from the thyroid |
| 4 |
1921 |
Banting and Best extracted insulin from islet cells of dog pancreas and used it to
lower blood sugar |
| 5 |
Early 1930s |
Pitt-Rivers and Harrington determined the structure of the thyroid hormone, thyroxine |
| 6 |
1935–40 |
Crystallization of testosterone |
| 7 |
1935–40 |
Identification of oestrogen and progesterone |
| 8 |
1940s |
Harris recognized the relationship between the hypothalamus and anterior pituitary |
| 9 |
1952 |
Gross and Pitt-Rivers identified tri-iodothyronine in human serum |
| 10 |
1955 |
The Schally and Guillemin laboratories showed that extracts of hypothalamus stimulated adrenocorticotrophic hormone (ACTH) release |
| 11 |
1956 |
Doniach, Roitt and Campbell associated antithyroid antibodies with some forms of hypothyroidism – the first description of an autoimmune phenomenon |
| 12 |
1950s |
Adams and Purves identified thyroid stimulatory auto-antibodies
Gonadectomy and transplantation experiments by Jost led to the discovery of the role for testosterone in rabbit sexual development |
| 13 |
1955 |
Sanger reported the primary structure of insulin |
| 14 |
1957 |
Growth hormone was used to treat short stature in patients |
| 15 |
1966 |
First transplant of human pancreas to treat type 1 diabetes by Kelly, Lillehei, Goetz
and Merkel at the University of Minnesota |
| 16 |
1969 |
Hodgkin reported the three-dimensional crystallographic structure of insulin |
| 17 |
1969–71 |
Discovery of thyrotrophin-releasing hormone (TRH) and gonadotrophin-releasing hormone (GnRH) by Schally’s and Guillemin’s groups |
| 18 |
1973 |
Discovery of somatostatin by the group of Guillemin |
| 19 |
1981–2 |
Discovery of corticotrophin-releasing hormone (CRH) and growth hormonereleasing hormone (GHRH) by Vale |
| 20 |
1994 |
Identification of leptin by Friedman and colleagues |
| 21 |
1994 |
First transplantation of pancreatic islets to treat type 1 diabetes by Pipeleers and colleagues in Belgium |
| 22 |
1999 |
Discovery of ghrelin by Kangawa and colleagues |
| 23 |
1999 |
Sequencing of the human genome – publication of the DNA code for
chromosome 22 |
| 24 |
2000 |
Advanced islet transplantation using modified immunosuppression by Shapiro and colleagues to treat type 1 diabetes |
|
Литература. Иллюстрации. References. Illustrations
Щелкни здесь и получи доступ в библиотеку сайта! Click here and receive access to the reference library!
- Aminoff M.J., Boller F., Swaab D.F., Eds. Human Hypothalamus: Basic and Clinical Aspects, Part I: Handbook of Clinical Neurology = Гипоталамус человека. Основы и клинические аспекты, Elsevier, 2003, 484 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Aminoff M.J., Boller F., Swaab D.F., Eds. Human Hypothalamus: Basic and Clinical Aspects, Part II: Handbook of Clinical Neurology = Гипоталамус человека. Основы и клинические аспекты, Elsevier, 2003, 484 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Björklund A., Hökfelt T., Swanson L.W., Eds. Handbook of Chemical Neuroanatomy, part III, Integrated Systems of the CNS) = Инегративные системы ЦНС, Elsevier, 1996, 600 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Dunnett S.B., Bentivoglio M., Björklund A., Hökfelt T., Eds. Handbook of Chemical Neuroanatomy, Dopamine = Дофамин, Elsevier, 2005, 418 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Gardner D.G., Shoback D.M. Greenspan's Basic & Clinical Endocrinology = Эндокринология. Основы, клиника. McGraw-Hill Medical, 2007, 960 p.
Иллюстрированное учебное пособие.
Цитаты: Формат .CHM, Формат .pdf.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Hökfelt T., Björklund A., Bloom F.E., Eds. Handbook of Chemical Neuroanatomy, The Primate Nervous System = Нервная система приматов, Part I, Elsevier, 1997, 552 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Melmed S., Polonsky K.S., Larsen P.R., Kronenberg H.M., Eds. Williams Textbook of Endocrinology = Эндокринология, 12th ed., Saunders, 2011, 1816 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Quirion R., Björklund A., Hökfelt T., Eds. Handbook of Chemical Neuroanatomy, Functional Neuroanatomy of the Nitric Oxide System = Функциональная нейроанатомия нитритоксидных (NO) систем нейронов, Elsevier, 2002, 426 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Steinbusch H.W.M., de Vente J., Vincent S.R., Eds. Handbook of Chemical Neuroanatomy, Functional Neuroanatomy of the Nitric Oxide System = Функциональная нейроанатомия нитритоксидных (NO) систем нейронов, Elsevier, 2000, 472 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
- Storm-Mathisen J., Ottersen O.P., Eds. Handbook of Chemical Neuroanatomy, Glutamate = Глутамат, Elsevier, 2000, 311 p.
Учебное пособие.
Доступ к данному источнику = Access to the reference.
URL: http://www.tryphonov.ru/tryphonov/serv_r.htm#0 quotation
См.: Неврология: Словарь,
Неврология: Ресурсы Интернет.
|
«Я У Ч Е Н Ы Й И Л И . . . Н Е Д О У Ч К А ?»
Т Е С Т В А Ш Е Г О И Н Т Е Л Л Е К Т А
Предпосылка:
Эффективность развития любой отрасли знаний определяется степенью соответствия методологии познания - познаваемой сущности.
Реальность:
Живые структуры от биохимического и субклеточного уровня, до целого организма являются вероятностными структурами. Функции вероятностных структур являются вероятностными функциями.
Необходимое условие:
Эффективное исследование вероятностных структур и функций должно основываться на вероятностной методологии (Трифонов Е.В., 1978,..., ..., 2015, …).
Критерий: Степень развития морфологии, физиологии, психологии человека и медицины, объём индивидуальных и социальных знаний в этих областях определяется степенью использования вероятностной методологии.
Актуальные знания: В соответствии с предпосылкой, реальностью, необходимым условием и критерием...
...
о ц е н и т е с а м о с т о я т е л ь н о:
— с т е п е н ь р а з в и т и я с о в р е м е н н о й н а у к и,
— о б ъ е м В а ш и х з н а н и й и
— В а ш и н т е л л е к т !
|
♥ Ошибка? Щелкни здесь и исправь ее! Поиск на сайте E-mail автора (author): tryphonov@yandex.ru
|



















